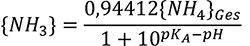Viele sind oft erstaunt, über ihren gemessenen "extrem hohen" Werte von "Ammoniak" von 0,5 mg/l und höher - ließt man doch aber oft von Höchstgrenzen von 0,05 mg/l - und greifen daher übereilt zu irgendwelchen teuren Mittelchen.
Um mit diesem mal aufzuräumen. Ihr meßt nicht das giftige Ammoniak ansich, sondern das "Gesamt-Ammonium", da Ammoniak temperatur- u. Ph-abhängig ist, das bei den herkömmlichen Tröpchentest nicht berücksichtigt wird.
Um euch mal den "Schrecken" zu nehmen, habe ich mich mal intensivst damit beschäftigt.
Herausgekommen ist eine eher extrakte Formel , einfach in Excel einzufügen -->
NH3 = 0,94412 * NH4 / (1 + 10 ^ ((0,0925 + (2728,795 / (T + 273,15 ))) - pH))
NH3 = Ammoniak | NH4 = gemessener Gesamtammoniumgehalt | pH = pH-Wert | T= Temperatur
Demzufolge ergäbe ein gemessener Wert von 0,5 mg/l Gesamtammonium, 25,0 °C und einem Ph von 8,15 einen unkritischen Wert von
0,04 mg/l Ammoniakanteil.
-------------------
Ich hoffe, ich erspare euch damit , unsinnige und teure "Mittelchen" ins Becken zu kippen, die nur einem nutzen: dem Händler. ![]()
Salzige Grüße , Steffen