Moin,
Ich habe am Wochenende mal wieder ein Kilo Natriumhydrogencarbonat zum Ausgleichen der KH gekauft, wenn die Dosierpumpe mal wieder etwas zu wenig abgegeben hat.. Nun stand auf der Packung : 314 gr. NaHCO² erhöhen in 100 Liter Meerwasser die KH um 1. Kann das sein? Dann müsste ich ja in mein Becken von ca. 500 Litern 1,5 Kg NaHCO ² geben um die KH um 1 anzuheben. Stimmt das? Ich finde gerade meinen " Glaser" nicht ![]()
Dosierung Natriumhydrogencarbonat
-
-
Müsste um den Faktor 100 zu hoch sein. Die alte Regel ist: eine Tablette Kaisernatron (ca. 3g) erhöht den kH pro 100l um 1.
-
Hallo Stefan,
die in der Praxis erreichbare maximale Löslichkeit von NaHCO3 liegt bei c.a. 85 g/Liter Osmosewasser.
Wenn Du eine solche Lösung herstellst, dann erhöhen 180ml dieser Lösung in Deinem 500Liter Becken die kH um 1dH.VG,
Bernhard -
Müsste um den Faktor 100 zu hoch sein. Die alte Regel ist: eine Tablette Kaisernatron (ca. 3g) erhöht den kH pro 100l um 1.
Moin,
dann fehlt wohl ein Komma auf der Packung . Kann man denn Kaisernatron oder Backsoda auch verwenden? Da sind ja doch Preisunterschiede im Vergleich zu aquaristischen Produkten.
. Kann man denn Kaisernatron oder Backsoda auch verwenden? Da sind ja doch Preisunterschiede im Vergleich zu aquaristischen Produkten. -
Hallo Stefan,
hier müsstn Deine Fragen beantwortet werden: http://www.mathgame.de/Aqua/Wasserparameter_FAQ.pdf
VG
Elisabeth
-
Danke Elisabeth,
manchmal denkt man nicht an das Naheliegendste .
. -
Moin,.... Kann man denn Kaisernatron oder Backsoda auch verwenden? Da sind ja doch Preisunterschiede im Vergleich zu aquaristischen Produkten.
Ja, kann man. Ich benutze die Packungen von der DM-Drogerie.
Natron DM
Du kannst auch andere Produkte nehmen, mußt aber schauen, dass es sich dabei um reines Natriumhydrogencarbonat handelt.
Die Dosierung ist, wie bereits von Sandy geschrieben, 3g/100Liter (Beckenwasser) erhöhen den KH um 1°. -
Hallo,
da muss ich dir widersprechen. Es ist auch möglich Natriumcarbonat zu verwenden. Abhängig vom vorliegenden PH Wert reagiert das Carbonation mit dem im Wasser gelösten CO2 zum Hydrogencarbonat und bindet somit sogar CO2, ähnlich dem Kalkwasser.
CO2, H2CO3, HCO3-, CO3-2 stehen in einer Gleichgewichtsreaktion im Zusammenhang. Die steuernde größe hierbei ist hauptsächlich der pH Wert.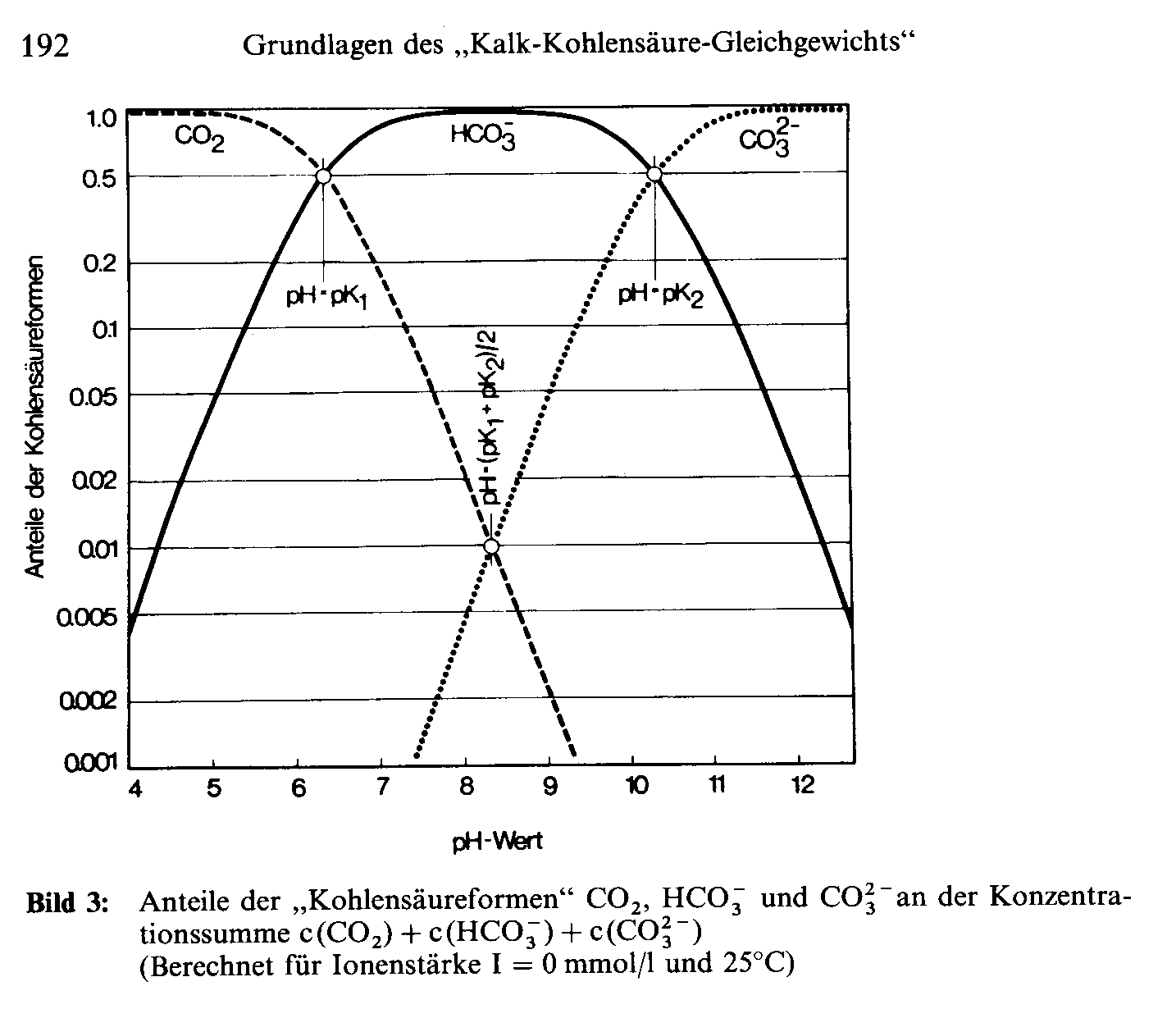
Der erste Wendepunkt liegt bei 6,3 hier liegt CO2, HCO3- in selben Verhältnis vor (50%/50%). Es kommt also kein CO32-. Der 2. Wendepunkt liegt bei 10,3. Hier liegen HCO3-, CO3-2 im Verhältnis 50%/50% vor. CO2 st gar nicht mehr vorhanden.
Bei Ph Wert 8,3. Glücklicherweise genau die Mitte der beiden Wendepunkt. Kann man der Grafik entnehmen das die natürliche CO2 bei 1%, die CO3-2ebenfalls eine Konzentration von 1% besitzt und im Umkehrschluss 98% als Hydrogencarbonat vorliegt.Damit es nicht zu Ausfällungen kommt sollte die Zugabe allerdings langsam erfolgen.
P.S. Ich verwende das Kaisernatron von Holste.
Gruß
- Robin
-
Moin,
Ich habe am Wochenende mal wieder ein Kilo Natriumhydrogencarbonat zum Ausgleichen der KH gekauft, wenn die Dosierpumpe mal wieder etwas zu wenig abgegeben hat.. Nun stand auf der Packung : 314 gr. NaHCO² erhöhen in 100 Liter Meerwasser die KH um 1. Kann das sein? Dann müsste ich ja in mein Becken von ca. 500 Litern 1,5 Kg NaHCO ² geben um die KH um 1 anzuheben. Stimmt das? Ich finde gerade meinen " Glaser" nicht
(Auch wenn der Thread etwas älter ist) - Ich antworte mal.
Am besten ist die Herstellung einer "Stammlösung". Niemals NaHCO³ direkt ins Wasser geben !!!
(wirkt "ätzend")
Ja, die Konzentration einer KH-Stammlösung liegt bei 80 g /Liter - sperat angesetzt.
Also nicht 1,5 Kg davon ins Becken "kippen" !!
----------
Beispiel : in deinenem Fall : 500 Liter- Becken.Man nehme einen 5 l - Kanister, und fülle ihn mit , nein - keine 5 l , sondern darunter . 4,6 l Osmosewasser, kein Salzwasser - sonst flockt es aus. Gut schütteln und weiter mit Wasser auffüllen, das man exakt auf 5.000 g kommt. (5.000 g - 400 g NaHCo² = 4.600 g Wasser)
Nun ist die "Stammlösung" fertig.Diese "Stammlösung" ist dementsprechend zu dosieren. In deinem Fall :
(3,02 * 500 Liter )/100 * (gewünschter Wert - gemessener Wert) * 12,5
-------------
3,02g ist das reine NaHCO³ um um 1° dH zu erhöhen (nicht 3,14 g !! )
500 l - das Beckenvolumen
gewünschter Wert = 8 °dH
gemessener Wert = sag ich mal einfach als Beispiel = 7,0 °dH
12,5 = Konzentration der Stammlösung ( 1.000 ml /80 g)
-------------
Setzen wir ein : (3,02 * 500 l)/100 * (8 °dH -7 °dH ) *12,5 = 188.75 ml der Stammlösung.Du benötigst also ~ 189 ml dieser "Stammlösung" um die KH in deinem 500 l -Becken um 1 zu erhöhen. Nicht 1,5 kg -
Dies ist nur eine einmalige Anhebung des KH´s - für eine tägliche Dosierung müsste man den täglichen/wöchendlichen "Verbrauch" kennen . (abhängig vom Besatz) . Ich messe meinen KH täglich, und kriege dank Excel die genaue Dosierung / Tag im ml - Bereich ausgespuckt

Zum ansetzen benutze ich auch "Kaiser Natron" oder "Bullrich Salz" - dies bitte nicht mit "Soda" verwechseln !! Natron = Natriumhydrogencarbonat (NaHCO³) = gut / "Soda" = Natriumcarbonat (Na²CO³) = schlecht.
Lg Steffen .
-
Moin Steffen
Vielen Dank für die ausführliche Herleitung. Zwar existiert das Becken mittlerweile nicht mehr, aber die Berechnung ist ja universell anwendbar .
. -
Natriumcarbonat (Na²CO³) = schlecht.
Hallo Steffen!
Warum schlecht?
Wird von vielen erfolgreich eingesetzt um den PH Wert zu erhöhen. -
12,5 = Konzentration der Stammlösung ( 1.000 ml /80 g)
Guten Tag,
ich möchte mir auch eine Stammlösung zubereiten und habe diese Anleitung hier gefunden - vielen Dank dafür!
Die Konzentration der Stammlösung kann ich allerdings nicht ganz nachvollziehen: Wenn ich 4600 ml Wasser mit 400g NaHCO³ vermische, wieso kommt dann "12,5" raus?
Müsste die Konzentration anhand von dem oberen Beispiel nicht 4600 / 400 = 11,5 betragen? Oder übersehe ich etwas?Vielen Dank!
Raphael
Jetzt mitmachen!
Du hast noch kein Benutzerkonto auf unserer Seite? Registriere dich kostenlos und nimm an unserer Community teil!

